Во следниов напис го разгледуваме приближниот процес за добивање battery grade литиум хидроксид од литиумска руда. Од приближно 40 t руда (1,5% Li₂O) се добиваат околу 10 t концентрат (6% Li₂O), односно крајно околу 1 t LiOH•H₂O (батери-грејд материјал за катоди). Во процесот за ова количество се користат 5-10 t концентрирана сулфурна киселина...
Да го разгледаме приближниот процес за добивање battery grade литиум хидроксид (рафиниран LiOH • H₂O со батериски квалитет) од литиумска руда, на пример, сподумен – LiAlSi₂O₆.
Да се обрати внимание на четвртиот чекор, киселинското пржење, како и неутрализацијата на киселината и прочистувањето/депонирањето на сулфати, коишто се еколошки најпроблематичните чекори.
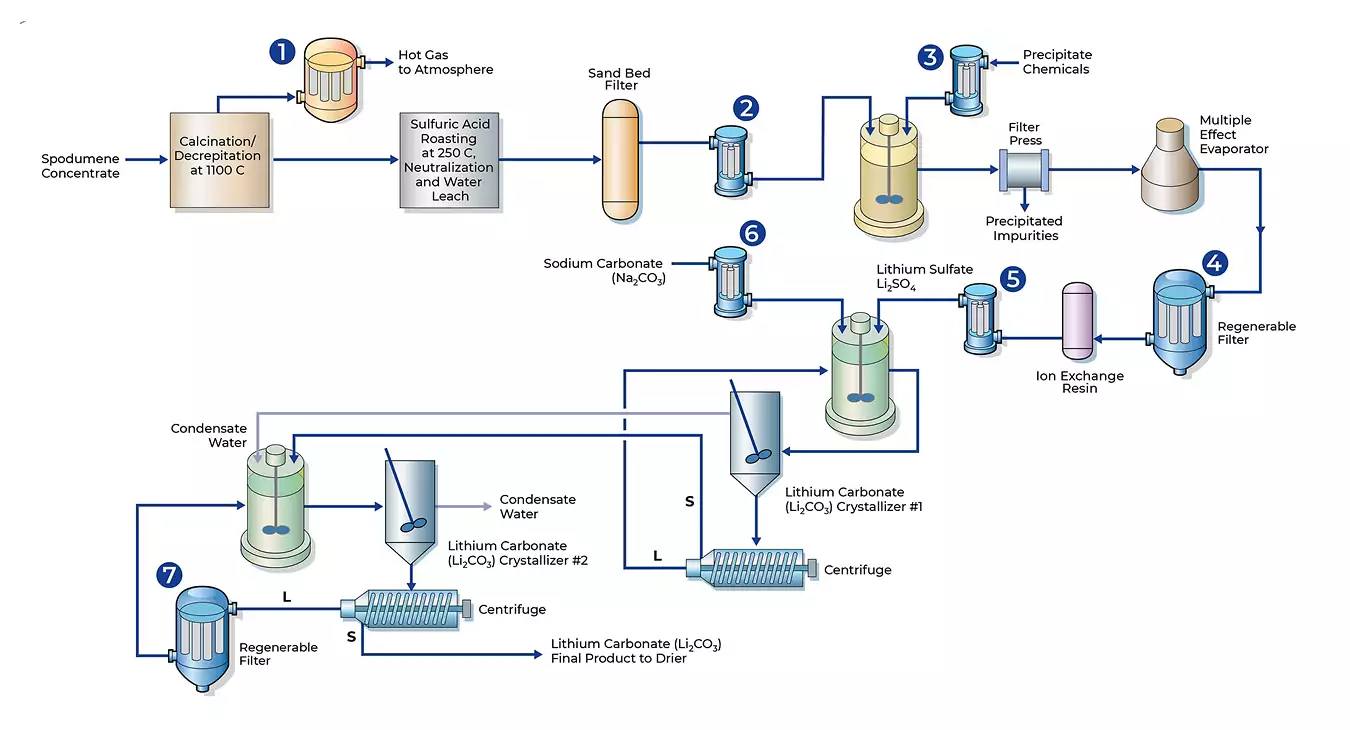
1. Рударење, дробење, мелење
Рудата со минералот сподумен, LiAlSi₂O₆ (со приближно 1,5% Li₂O еквивалент) се дроби и се меле за флотација.
2. Флотација – збогатување преку пенење
Дотука нема хемиски реакции, а продукт е концентрат со приближно 6% Li₂O еквивалент, што во некои рудници е финален производ за продажба. Пенилото не е многу штетно, но сепак е потребен третман на отпадните води.
3. Термичка конверзија (калцинација)
Активирање на сподуменот – структурна трансформација на кристалите при 1000 – 1100 °C, без промена на хемискиот состав.
α-LiAlSi₂O₆ → β-LiAlSi₂O₆
4. Киселинско пржење – дигестија (сулфатен начин)
Литиумот се ослободува од минералната матрица во концентратот со дигестија, обично со концентрирана сулфурна киселина на 200-250 °C.
За дигестија се користат огромни количини концентрирана сулфурна киселина, околу 500-1000 kg H₂SO₄ по тон концентрат. Доколку сета киселина изреагира, продуктите се литиум сулфат и обична вода:
Li₂O + H₂SO₄ → Li₂SO₄ + H₂O
Но, секогаш има вишок на сулфурна киселина што треба да се неутрализира, обично со сода бикарбона или со гасена вар.
Во реалноста Li во β-LiAlSi₂O₆ е тој што се сулфатизира; Al и Si од сподуменот преминуваат во нерастворливи фази (алуминиум силикат, силициум сулфат), што се отстрануваат со филтрација.
Но, во процесот на неутрализирање на сулфурната киселина (на пример со сода бикарбона) остануваат големи количини сулфати на натриумот, но и сулфати на алуминиумот и магнезиумот (од реакциите на киселината со рудата), коишто се лесно растворливи во вода. Иако не се токсични, бараат внимателно одлагање и чување, заради заштита на подземните води. Ако се неутрализира со Ca(OH)₂ (гасена вар), се добива CaSO₄ (гипс) што е нерастворлив во вода. Можен е и неизреагиран вишок на сулфурна киселина.
5. Прочистување на растворот – дилуција и филтрирање
Водениот раствор на Li₂SO₄(aq) се чисти од јони на железо, алуминиум, магнезијум, калциум и натриум (Fe³⁺, Al³⁺, Mg²⁺, Ca²⁺, Na⁺) со pH-контрола, таложења и филтрации.
Ca²⁺ + CO₃²⁻ → CaCO₃ ↓
Mg²⁺ + CO₃²⁻ → MgCO₃ ↓
6-а) Конверзија во литиум сулфат со натриум карбонат или натриум хидроген карбонат – сода бикарбона (опционален чекор)
Li₂SO₄ (aq) + Na₂CO₃ (aq) → Li₂CO₃ (s) ↓ + Na₂SO₄ (aq)
Кристализација и полирачко пречистување на литиум карбонатот со јоизменувачки маси, адсорбенти (активен јаглен) и нанофилтрација до battery-grade Li₂CO₃.
6-б) Директна конверзија во литиум хидроксид (алтернативно)
Некои шеми вршат директна алкализација на сулфатниот раствор (со мембрани/јоноизменувачи), но најраспространето е преку карбонат (чекорот 6-а).

7. Конверзија на Li₂CO₃ со помош на Ca(OH)₂ (гасена вар) во литиум хидроксид и хидратизација
Li₂CO₃(s) + Ca(OH)₂(s) → 2 LiOH(aq) + CaCO₃(s) ↓
Литиум хидроксидот се раствора, филтрира, концентрира и се кристализира како монохидрат:
LiOH(aq) + H₂O → LiOH•H₂O(s)
8. Батери-грејд прочистување
Прочистување на LiOH•H₂O до >99,5% чистота со отстранување на Mg²⁺, Ca²⁺, Na⁺ и други нечистотии, бидејќи батериските катоди се чувствителни.
Забелешки:
• Од приближно 40 t руда (1,5% Li₂O) се добиваат околу 10 t концентрат (6% Li₂O), односно крајно околу 1 t LiOH•H₂O (батери-грејд материјал за катоди). Во процесот за ова количество се користат 5-10 t концентрирана сулфурна киселина.
• Наместо Na₂CO₃ може да се користи NaHCO₃ (сода бикарбона) или бази. Формулите погоре се најчестата индустриска комбинација.