Нобеловата награда за хемија оваа година им оддава почест на креаторите на компјутерските алатки што ја трансформираа биологијата и кои имаат потенцијал да ја револуционизираат фармакологијата и процесите на откривање нови лекови.
За првпат, а веројатно не и последен, научен пробив овозможен од вештачката интелигенција е признаен со Нобелова награда. Нобелот за хемија за 2024 година оди во рацете на Џон Џампер и Демис Хасабис од Google DeepMind во Лондон, Велика Британија, за развој на алатката за вештачка интелигенција AlphaFold, која ја целосно ја промени можноста за предвидување протеински структури, и Дејвид Бејкер од Универзитетот во Вашингтон во Сиетл, за неговата работа на компјутерскиот дизајн на протеини, процес кој последниве години беше револуционизиран со примена на вештачката интелигенција.
Влијанието на AlphaFold, ВИ алатката претставена пред само неколку години, беше трансформативна за хемијата и биологијата. Алатката ги направи протеинските структури достапни за истражувачите со притисок на копче и овозможи експерименти кои пред само една деценија беа незамисливи. Биолозите сега зборуваат за ерата „пред AlphaFold“ и онаа што уследи потоа.
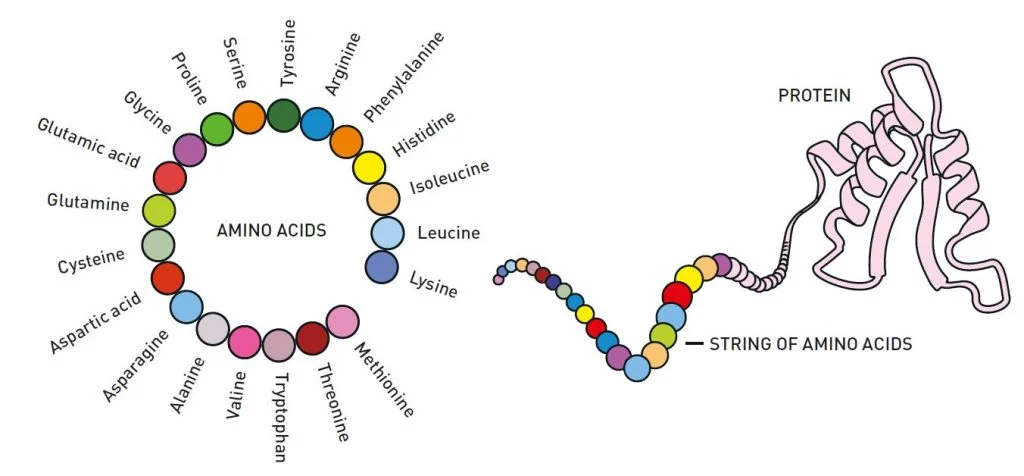
Протеинот може да се состои од десетици до неколку илјади аминокиселини. Низата од аминокиселини се преклопува во тродимензионална структура која е одлучувачка за функцијата на протеинот. Слика: Johan Jarnestad/The Royal Swedish Academy of Sciences
„Одамна беше сон да се научи да се предвиди тродимензионалната структура на протеините од познавањето на нивните аминокиселински секвенци... со децении ова се сметаше за невозможно“, рече претседателот на Нобеловиот комитет Хајнер Линке, кој ја истражува нанонауката на Универзитетот Лунд во Шведска при објавувањето на наградата. "Овогодинешните лауреати", додаде тој, „го пробија кодот“. Победниците делат парична награда во вредност од 11 милиони шведски круни (околу 1 милион американски долари или нешто помалку од 1 милион евра).
DeepMind ја претстави AlphaFold во 2018 година. ВИ алатката тогаш триумфираше на биеналниот натпревар за предвидување на структурата на протеините наречен Критичка проценка за предвидување на структурата на протеините (Critical Assessment of Protein Structure Prediction – CASP). Но, сериозните тектонски поместувања во сферата дојдоа со втората итерација на невронската мрежа за длабоко учење, претставена кон крајот на 2020 година.
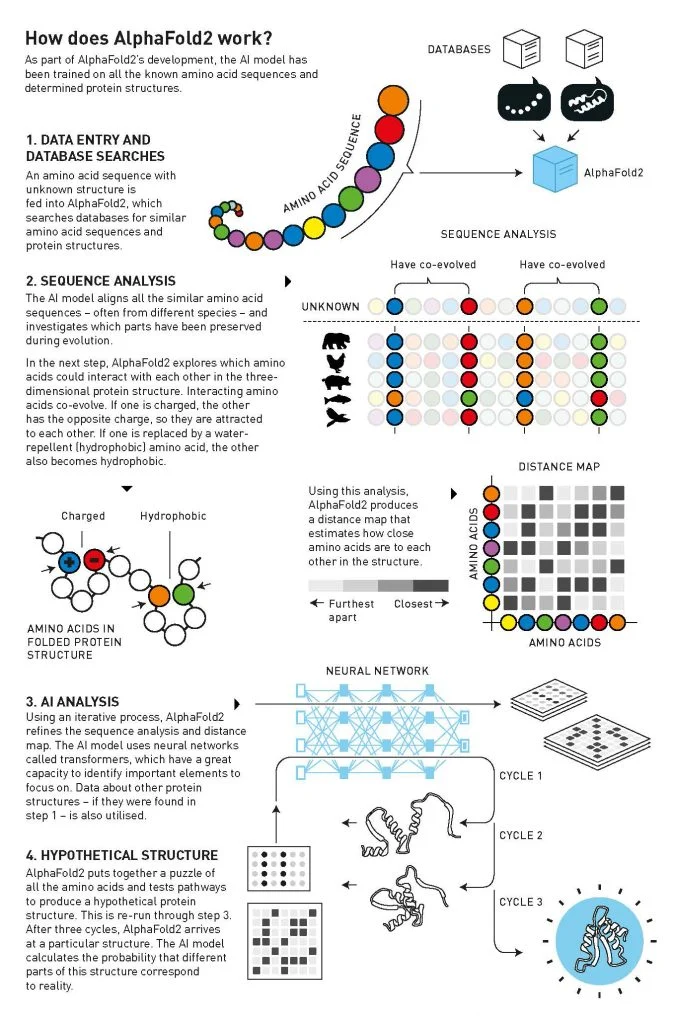
Како функционира AlphaFold? Слика: Johan Jarnestad/The Royal Swedish Academy of Sciences
Многу од предвидувањата на AlphaFold2 во CASP беа толку точни што не можеа да се разликуваат од експериментално решените протеински структури. Ова го поттикна Џон Моулт, коосновачот на CASP и пресметковен биолог од Универзитетот во Мериленд во Колеџ Парк, да изјави во 2020 година дека „во извесна смисла, проблемот е решен“.
Хасабис, коосновачот и извршен директор на DeepMind, и Џампер, шеф на AlphaFold тимот, го предводеа развојот на AlphaFold2. За да се предвидат протеинските структури, невронската мрежа инкорпорира слични структури од базите на податоци на стотици илјади експериментално решени структури и милиони секвенци од сродни протеини – кои содржат информации за нивните форми.
Во 2021 година, DeepMind го направи основниот код на AlphaFold2 слободно достапен, заедно со податоците потребни за обука на моделот. Базата на податоци AlphaFold, создадена во соработка со Европската лабораторија за молекуларна биологија при Европскиот институт за биоинформатика во Хинкстон, ОК, сега ги содржи структурите на речиси сите протеини од секој организам претставен во генетските бази на податоци, вкупно околу 214 милиони предвидувања. Оваа година, компанијата ја претстави третата верзија на AlphaFold, која може да моделира други молекули кои комуницираат со протеините, какви што се лековите.

Топ 7 – првиот протеин кој беше целосно различен од сите познати постоечки протеини Слика: Terezia Kovalova/The Royal Swedish Academy of Sciences
Револуцијата што ја покренаа Џампер, Хасабис и нивните колеги сѐ уште е во зачеток, а целосното влијание на AlphaFold врз науката можеби нема да биде познато со години. Алатката веќе им помага на научниците во остварувањето на нови сознанија.
Еден пионерски тим ја искористи алатката, заедно со експерименталните податоци, за да го мапира комплексот на јадрените (нуклеусните) пори, една од најголемите машини на нашите клетки, чуварот на геномот наречен комплекс на нуклеусните пори. Минатата година, два тима ја “прекопаа” целата податочна база на AlphaFold за да ги откријат најтемните агли на протеинскиот универзум, идентификувајќи нови семејства на протеини и протеински набори и изненадувачки врски во механизмот на животот.
Многу истражувачи се надеваат дека AlphaFold и другите ВИ алатки што таа ги инспирираше, ќе ја трансформираат медицината, но сè уште не е јасно како, или дали навистина AlphaFold ќе го трансформира скапиот и повеќестепен процес на развој на безбедни нови лекови.
Повеќе од една деценија пред DeepMind да започне да работи на AlphaFold, пресметковниот биофизичар Дејвид Бејкер од Универзитетот во Вашингтон во Сиетл и неговите колеги развија софтверски алатки за моделирање на протеинските структури користејќи физички принципи наречени Rosetta. Алатката имаше ран успех во дизајнирањето на нови протеини. Таа беше на првите места во добар дел од CASP натпреварите, пред да настапи хегемонијата на AlphaFold.
Со текот на годините, тимот на Бејкер ја применуваше Розета за предвидување на структурата на протеините, но и за дизајнирање на нови протеини како што ензими и самосклопувачки протеински наночестички.
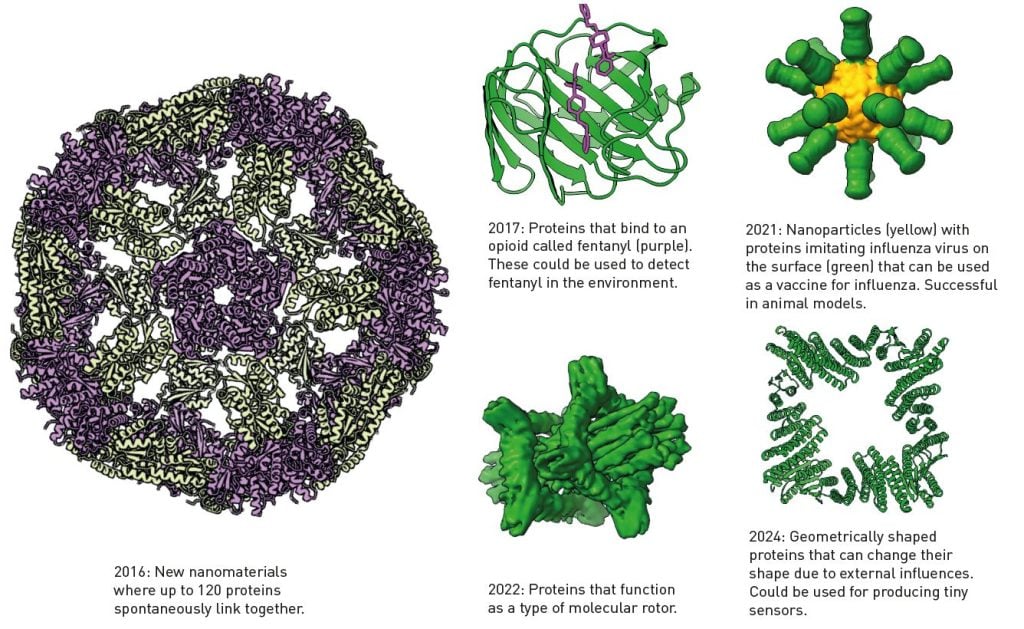
Протеини развиени со Бејкеровиот програм Розета Слика: Terezia Kovalova/The Royal Swedish Academy of Sciences
По најавата за AlphaFold2, Бејкер и неговиот тим, вклучувајќи го и пресметковниот хемичар Минкиунг Баек, кој сега работи на Националниот универзитет во Сеул во Јужна Кореја, тргнаа да го разберат софтверот и да применат некои од неговите трикови на претходната верзија на вештачка интелигенција заснована на Розета. Првата верзија на добиената RoseTTAFold мрежа имаше речиси подеднаков успех како и AlphaFold2.
Од 2021 година, обете мрежи постојано се подобруваат од нивните развојни инженери, но и од страна на други научници (поради достапноста на кодот), за да се справат со новите предизвици, како што е предвидувањето на структурата на комплексите на повеќе различни протеини во интеракција.
Последниве години, тимот на Бејкер беше особено плоден во примената на машинското учење во неговата лабораторија, со создавање на нови протеини, досега невидени во природата. Алатката развиена неодамна од тимот на Бејкер, која го спојува RoseTTAFold со дифузните невронски мрежи способни да генерираат слика, доведе до значителна промена во способноста на истражувачите да дизајнираат протеини.

Протеински структури утврдени со помош на AlphaFold2 Слика: Terezia Kovalova/The Royal Swedish Academy of Sciences
Иако компјутерските алатки како AlphaFold не се замена за експерименталните истражувања, тие се своевиден акцелератор, велат научниците.
Објаснувајќи го значајот и влијанието на ВИ алатките на полето на биологијата и хемијата, еволуцискиот биолог Андреј Лупас, од Макс Планк Институтот за развојна биологија во Тибиген, Германија, уште во 2020 година изјави за Nature: “Ова ќе ја поттикне новата генерација на молекуларни биолози да поставуваат понапредни прашања”