Тим истражувачи од Универзитетот Дјук развија метод за проширување на досегот на CRISPR технологиите. Ако оригиналниот CRISPR систем можеше да таргетира само 12,5% од човечкиот геном, новиот метод го проширува пристапот до речиси секој ген за потенцијално таргетирање и лекување на поширок опсег на болести со инженеринг на геномот. Во истражувањето биле вклучени и научници од Универзитетот Харвард, Технолошкиот институт во Масачусетс, Медицинскиот факултет при Универзитетот во Масачусетс, Универзитетот во Цирих и Универзитетот Мекмастер, а резултатите се објавени денес во Nature Communications.
CRISPR-Cas е бактериски имунолошки систем кој им овозможува на бактериите да ги користат молекулите на РНК и протеините поврзани со CRISPR (Cas) за да ја таргетираат и уништат ДНК на инвазивните вируси. Од неговото откритие до денес, истражувачите развиваат арсенал на нови CRISPR системи што може да се применат во генската терапија и геномскиот инженеринг.
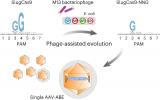
За да се направи уредување на геномот, Cas протеините користат и молекула на РНК, која го води ензимот до целниот дел од ДНК, и придружниот мотив на протоспејсерот (protospacer adjacent motif – PAM), којшто претставува кратка ДНК секвенца која непосредно ја следи целната ДНК секвенца, а е потребна за врзување на Cas протеинот.
Откако РНК водилката ќе ја пронајде својата комплементарна ДНК секвенца и Cas ензимот ќе го врзе соседниот PAM, ензимот делува како ножички за да направи засек во ДНК, предизвикувајќи ги саканите промени во геномот. Најчестиот CRISPR-Cas систем е Cas9 од бактеријата Streptococcus pyogenes (SpCas9), за кој е потребна PAM секвенца од две последователни гванински бази (GG).
Слика: Nature Chemical Biology (2023). DOI: 10.1038/s41589-023-01481-5
Во нивното претходно истражување, Пранам Чатерџи и неговиот тим од Дјук Универзитетот користеле биоинформатички алатки за откривање и инженеринг на нови Cas9 протеини, вклучувајќи го и Sc++, за што е потребна само една единствена гванинска база на PAM за да се направи засек. Оваа промена им овозможи на истражувачите да уредуваат речиси 50% од сите секвенци на ДНК.
Истовремено, соработниците на Чатерџи од Харвард, предводени од Бенџамин Клајнстивер, изработиле друга варијанта наречена SpRY. Иако SpRY можеше да се врзе со која било од четирите ДНК бази основи што може да го формираат PAM, тој имаше многу посилен афинитет кон аденин и гванин.
Со оглед на тоа дека обата системи имале недостатоци, групата одлучила да го спои најдоброто од двата система во една нова варијанта наречена SpRyc.
Иако SpRYc бил побавен од другите алатки при сечењето на целните секвенци на ДНК, тој бил поефективен од двата традиционални ензими во уредувањето на специфични делови од ДНК. И покрај широкиот опсег на делување на SpRYc, тој исто така бил и попрецизен од SpRY.
По воспоставување на можностите на SpRYc за уредување на геномот, тимот ги разгледал и потенцијалните терапевтски употреби на алатката за третирање на генетски болести што не се лекуваат со стандардниот CRISPR систем. Нивниот прв тест бил Рет синдромот, прогресивно невролошко нарушување кое претежно ги погодува младите жени и е предизвикано од една од осумте мутации на точно одреден ген. Втора тест била Хантингтоновата болест, ретко, наследно невролошко нарушување кое предизвикува дегенерација на невроните во мозокот. Тимот открил дека SpRYc може да ги промени претходно недостапните мутации, обезбедувајќи потенцијални терапевтски можности за двете болести.